В уравнения для определения избыточного давления взрыва, на основе которого и происходит расчет пожарных категорий, опосредовано, включена молярная масса (далее - Мол. М, (М)).
И если для индивидуальных веществ она определяется достаточно просто (на нашем сайте, в разделе «онлайн-расчет» есть таблица Менделеева, нажав на нужные элементы которой, можно автоматически рассчитать ММ любого индивидуального соединения) то при определении данной величины для группы индивидуальных соединений могут возникать некоторые затруднения.
Специалисты выходят из этого положения более-менее просто – используют нормативное условие, допускающее вычисление нужных параметров не по всей смеси, участвующей в процессе горения, а по наиболее опасному компоненту этого соединения используя формулу А1 СП 12.13130. В этой статье мы ссылались на работу Г.Т. Земского, по тому, как определить наиболее опасный компонент для определения избыточного давления по указанному уравнению, и в принципе такой подход имеет право на существование. Тем более, что он описан в методической литературе и подтвержден авторитетом авторов учебных пособий и учреждений их издавших.
Но есть несколько соображений против этого подхода. Во-первых, нормативно «допускается», вовсе не означает «разрешается». Это допускается, если по каким-то причинам выполнить определение параметров взрыва невозможно по формуле А.4. Это не автоматический карт-бланш. Такое решение всегда нужно обосновать.
Во-вторых, при таком подходе снижается достоверность. Исключая из процесса имеющееся горючее мы не учитываем некоторые вещества, реально влияющие на опасность. А это, в свою очередь, приводит к тому, что и без того недостоверная методика становится еще более «приближенной». Конечно, есть и обратные случаи, когда проведение вычислений по наиболее опасному компоненту завышает категорию. И это дает повод многим повод упрекнуть специалистов в неразумных тратах, завышенных, неоправданных. Это достаточно справедливые упреки. Основатель научной дисциплины «Профилактика» В.А. Эллисон предупреждал коллег от огульного продвижения норм, без учетов интересов предприятий. Он говорил, что не объекты для инспектора, а инспектор для человека.
Поэтому корректнее использовать при получении значения изменения давления формулу А.4 названного выше Свода правил, для чего нам необходимо знать (М) смеси, чтобы определить интенсивность её испарения.
И мы, признавая мнение В.А. Эллисона правильным, хотим представить вниманию коллег полезное уравнение, по которому, можно весьма эффективно произвести вычисление рассматриваемой величины (М) для совокупности веществ.
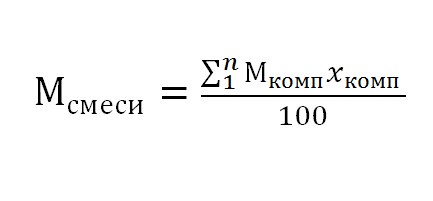
Возьмем, для примера, растворитель 646 и посмотрим, как это работает. Этот продукт состоит из следующих компонентов: Ацетон 10%; Этилцеллозольва 8%; Амилацетат 10%; Бутанол 10%; Этанол 15%; Толуол 50%.
Тогда порядок исчисления будет таков:
Ацетон 10% С3Н6О = (12 × 6 +12+16 × 2) 10 = 580
Этилцеллозольва 8% С4Н10О2 = (12× 4+10+16 × 2) 8 =720
Амилацетат 10% С7Н14О2 = (12 × 7+14+16 × 2) 10 = 1300
Бутанол 10% С4Н9ОН = (12 × 4+10+16) 15 =1110
Этанол 15% С2Н5ОН = (12 × 2+6+16) 10 = 460
Толуол 50% : С7Н8=(12 × 7 +8) 50 = 4600
Соответственно значение М растворителя 646 будет:
(580+720+1300+1110+460+4600)/100 = 87,6 г/моль
При этом для i-го компонента смеси (М)i возможно определить и в специальном разделе сайта //firecategory.ru после чегоэти значения для подстановки в представленную в этой статье формулу.
В ближайшее время мы разместим в разделе «онлайн-расчеты» сайта специальную форму для исчисления М совокупности индивидуальных веществ.
Мы рассчитываем, что эти наработки, мысли будут полезными и позволят усовершенствовать то, чем мы занимаемся.



Для газов - применима, согласен, так как у них и массовая доля, и мольная равны! А для жидкостей - категорически нет. Возможный вариант расчета я указал по ссылке в комментарии ниже (к слову говоря, для рассматриваемого примера результат отличается на 10%, а для некоторых растворов это значение может быть гораздо больше). Что касается реакционной способности веществ, то здесь тоже нет противоречия. Если происходит реакция, то в растворе с определенной массовой долей появляется новое вещество. Его мы тоже учитываем, как еще один компонент (если этого вещества образуется действительно много) ...Все! Давление насщенных паров смеси определяем суммирование давлений паров компонентов, умножая каждый компонент на мольную долю (уже писал про Дальтона)...
Я считаю, что приводимая в статье формула, допустима для определения молярной массы смеси.
Для газов она работает на 100%. Согласно закону Авагадро: один моль любого газа при одинаковых условиях занимает одинаковый объём.
Например, известно, что молярная масса воздуха равна 28,9 г/моль. Рассчитывается следующим образом:
М=0,21 О2 + 0,79 N2 ≈ 28,98 г/моль
Для смесей жидкостей с некоторыми допущениями ее так же можно использовать. Блинов и Худяков классифицируют смеси жидкостей на три основные группы:
– смеси жидкостей, смешивающиеся во всех отношениях, образуя однородные растворы;
– смеси жидкостей, смешивающихся частично;
– смеси жидкостей, практически нерастворимых друг в друге.
В чем заключаются допущения? Вещества в смеси взаимодействуют друг с другом. Например, смешивая 40% этанола и 60 % изопропанола, не совсем корректно будет говорить, что в итоговой смеси находится 40 % и 60% исходных веществ. Происходит межмолекулярное взаимодействие. Но погрешность в расчетах будет не более 1%. Парировать это, в принципе, можно законом сохранения масс. Мы можем утверждать, что масса конечной системы будет равна сумме масс исходных компонентов. Таким образом, формула применима.
Касательно, комментариев вышеуказанных к статье. Действительно, в газовой фазе соотношение компонентов не будет равно соотношению тех же компонентов, находящихся в жидкой фазе. Согласно первому закону Коновалова, мольная доля низкокипящего компонента в паровой фазе будет больше, чем в жидкой. И применять в этом случае формулу, для расчета молярной массы смеси газов (если при этом использовать массовую долю компонентов в жидкой фазе), будет некорректно.
Да, и по поводу парциального давления смеси - здесь тоже все просто - пользуемся законом Дальтона...Это, по-моему, всем известный факт..Нас так учили считать в свое время.
Так как комментарий к статье не предполагает прикрепление файла, а набирать формулы очень не удобно, я приложил ссылку на файл, где указал свои соображения по расчету молярной массы смеси. Они мне кажутся более логичными и простыми. Вот ссылка на файл: https://yadi.sk/i/vn0d1lBs3KRfwc
Я так считаю всегда...Может, здесь есть ошибка, но мне кажется, что это более логично, чем то, что приводится в статье.
И еще. Я думаю вы знакомы с таким понятием как "ректификация". а значит все не линейно....
Уважаемый павел Юрьевич. Несмотря на наши полититические и методологические разногласия всегда открыт к сотрудничеству. :-)
Я химик по первому своему образованию (пожарюга я только "вторично" - по второму образованию :-) ), но тоже пока не вижу простого метода расчета для данного случая.
Уважаемый Андрей Витальевич, спасибо за интересные замечания. Буду думать. Я, к сожалению, никакой физик и еще худших химик, так что времени на раздумье будет нужно много.
Еще раз спасибо!
Привожу ссылку просто для размышления по поводу написанному мною ранее комментария:
http://chemlib.ru/books/item/f00/s00/z0000028/st005.shtml
Начну по порядку.
1. Касательно того, что "допускается не означает "зазрешается" - не согласен, именно это оно и означает, но это не существенно в контексте данного обсуждения.
2. Согласен с автором статьи и В.А. Эллинсоном , что выбор по наиболее опасному веществу не есть лучший и правильный выбор и все же надо стремиться учитывать все компоненты смеси.
3. Предлагаемый расчет Молярной массы смеси не лишен недостатков, хотя по своему интересен.
Какой главный недостаток я вижу:
- Концентрация паров компонента смеси не обязательно пропорциональна концентрации его жидкой фазы в смеси, а зависит и от температуры кипения данного компонента, а соответственно и от текущей температуры данной смеси, зависит и от скорости испарения при температуре до точки кипения данного компонента смеси.... иными словами парциальное давление компонента смеси есть более сложная функция, чем простое соотношение концентраций жидкой фазы в исходной смеси.
А значит соотношение концентрации паров данного компонента смеси не линейно зависит от соотношения концентрации этого компонента в жидкой фазе.
Вывод: Предлагаемая формула требует уточнения но при этом я не исключаю, что точность расчетов по этой формуле для конкретных целей определения категории помещения может оказаться достаточной для практического ее применения.... но сомнения пока остались...